Apotheker, eigene Sterilherstellung, pharmazeutischer Unternehmer

Leben retten & Nebenwirkungen reduzieren ist unsere Motivation.
Wir, die Tcell Tolerance GmbH, sind eine am 17.02.2017 gegründete Risikokapital-Gesellschaft (GmbH) mit Sitz im Herzen von Leipzig.
Als Start-up-Unternehmen streben wir die Entwicklung einer innovativen Therapiestrategie zur Prävention der Transplantat-gegen-Wirt-Erkrankung (engl. graft-versus-host disease, GvHD) nach allogener peripherer Zelltransplantation an. Unser Ziel ist es, die Sicherheit dieser Behandlungsverfahren zu erhöhen und die Translation dieser Therapiestrategie in die klinische Praxis zu ermöglichen.
Kooperation mit dem Fraunhofer IZI
Fraunhofer forscht – Tcell kommerzialisiert !
Das Fraunhofer IZI ist eines der weltweit führenden Forschungsinstitute in den Bereichen Zell- und Gentherapie.
Die Tcell Tolerance GmbH setzt die Forschungsergebnisse der Abteilung Zell- und Gentherapieentwicklung unter Leitung von Prof. Dr. Stephan Fricke in die Anwendung am Menschen um und kommerzialisiert diese (aktuell GVHD-Prävention).
Grundlage der Zusammenarbeit bildet ein exklusiver Lizenzvertrag für die Verwertung. Aufgrund der vielfältigen Anwendungsmöglichkeiten des monoklonalen Antikörper MAX16.H5 werden zukünftig weitere pharmazeutisch kommerzialisierbare Projekte im Rahmen der Auftragsforschung realisiert (ff).
Das Tcell Schlüsselpersonal
Dr. Uwe Krasselt
Geschäftsführer
Prof. Dr. med. Ulrich Räth
Klinische Entwicklung
Hämatologe, med. Onkologe, Expertise als Global Head Medical Affairs internationaler Contract Research Organisations (CROs), Beratung internationaler Pharmaunternehmen und Biotechs, Fachwissen auf dem Gebiet von Arzneimittelzulassungen (FDA, EMA, PEI)
Tobias Großmann
Qualitätssicherung
Apotheker, Qualified Person, Erfahrung im Bereich GMP-Sterilherstellung, Anlagen- und Prozessvalidierung und Herstellungsleiter klinische Prüfpräparate
Lilly Stahl
Projektmanagement
Dipl.-Biochemikerin, Schwerpunkte In-vitro-Toxizität und statistische Modellierung
Die Problemstellung — GvHD
GvHD-Prävention durch anti-humane CD4-Antikörper mit erhaltenem GvL-Effekt
Die Transplantat-gegen-Wirt-Erkrankung (engl. graft-versus-host disease, GvHD) ist die Hauptkomplikation, die nach einer hämatopoetischen Zelltransplantation auftritt. Sie verläuft häufig tödlich oder verursacht schwere Langzeitschäden, die eine dauerhafte Therapie erfordern. Klinische Symptome umfassen allgemeine immunologisch ausgelöste Entzündungen, die bevorzugt Haut, Darm und Leber betreffen. Die Wahrscheinlichkeit des Auftretens einer akuten GvHD (Grad II bis IV) nach Zelltransplantation beträgt über 30 %, während die Wahrscheinlichkeit für eine chronische GvHD bei 40 % liegt.
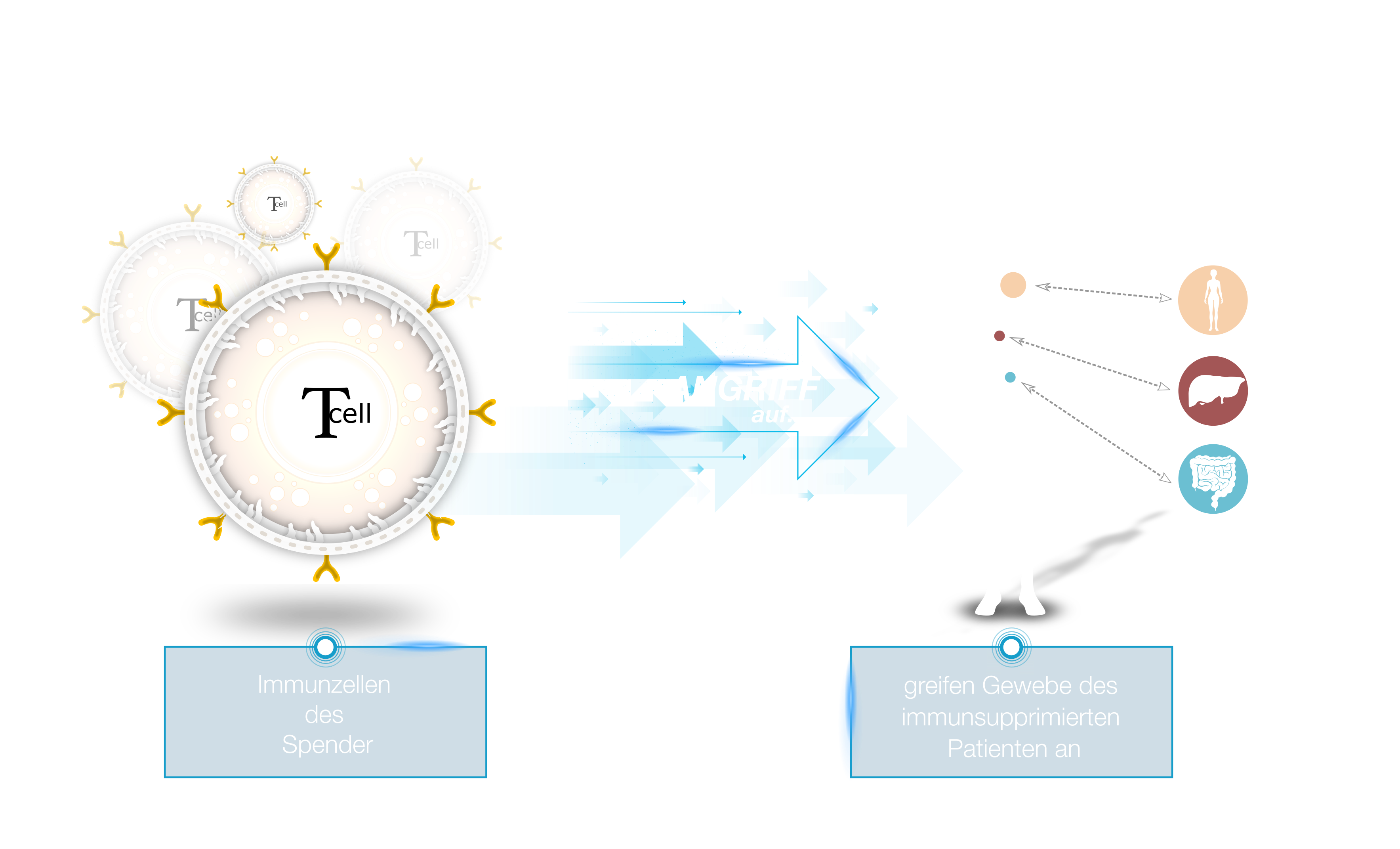
Die derzeitigen Behandlungsoptionen mit Immunsuppressiva führen zu unzähligen, unerwünschten Nebenwirkungen wie Infektionen, Rezidive und einer verringerten Wirksamkeit des Transplantats gegen Tumorzellen (GvL-Effekt).
In Deutschland werden jährlich etwa 3.500 allogene Zelltransplantationen durchgeführt. In ganz Europa sind es rund 15.000 Transplantationen. Die Behandlungskosten für die häufigste Nebenwirkung, die Transplantat-gegen-Wirt-Erkrankung (GvHD), belaufen sich auf 75.000 EUR bis 220.000 EUR pro Patient.
Die derzeitigen Behandlungsoptionen für GvHD sind mit hohen Kosten und zahlreichen Nebenwirkungen verbunden. An diesem Punkt setzt die Tcell Tolerance GmbH an und versucht, mit einem völlig neuen Therapieansatz sowohl die Kosten als auch die Nebenwirkungen drastisch zu senken. Im Gegensatz zur Depletion (Eliminierung) oder Suppression/Inaktivierung der T-Zellen durch herkömmliche Präparate wird dies durch eine Modifikation der T-Zellen mittels Ex-vivo-Inkubation mit dem Präparat ATMP Palintra® erreicht.
Die Innovation
GvHD-Prävention durch anti-humane CD4-Antikörper mit erhaltenem GvL-Effekt
Die akute Transplantat-gegen-Wirt-Erkrankung (engl. acute graft-versus-host disease, aGvHD) ist die Hauptkomplikation nach allogener hämatopoetischer Zelltransplantation. Herkömmliche Behandlungsmethoden sind oft mit geringem Langzeiterfolg und schweren unerwünschten Wirkungen verbunden, weshalb die Entwicklung weniger belastender Therapiealternativen dringend notwendig ist.
Die Tcell Tolerance GmbH verfolgt einen innovativen Ansatz zur Prävention der aGvHD durch den Einsatz eines spezifischen anti-humanen CD4-Antikörpers (MAX.16H5). Dieser Antikörper reduziert gezielt unerwünschte Immunreaktionen und verringert somit das Risiko einer aGvHD nach Zelltransplantationen. Präklinische Studien zeigen, dass der Transplantat-gegen-Leukämie-Effekt (engl. graft-versus-leukemia, GvL) erhalten bleibt.

Von besonderer Bedeutung ist, dass die systemische Gabe des Antikörpers vermieden werden kann, indem lediglich das allogene Zelltransplantat vor der Transplantation mit dem Antikörper behandelt wird. Nicht gebundene, überschüssige Antikörpermoleküle werden durch einen definierten Waschvorgang in einem abgeschlossenen System entfernt. Dies wirkt sich positiv auf die Immunkompetenz des Empfängers aus, da das Auftreten infektiöser Komplikationen verringert wird. Auch wenn die bisherige kontinuierliche, immunsuppressive Therapie nicht vollständig abgesetzt werden kann, könnte ihre Dosis reduziert werden, was die Toxizität der Behandlung insgesamt vermindert.
Eine geringere Antikörperdosis senkt zudem die Behandlungskosten erheblich und ist daher wirtschaftlicher. Neben den medizinischen Problemen können je nach Transplantationsprotokoll für eine GvHD-Behandlung derzeit Kosten zwischen 75.000 EUR und 225.000 EUR pro Patient entstehen. Gelingt es, die GvHD zu unterdrücken oder zumindest in ihrer Schwere zu minimieren, würde dies zur Entlastung des Gesundheitssystems beitragen und den Erfolg der gesamten Behandlung erhöhen.
Klinische Prüfung
Transfer in die Klinik
Die klinische Prüfung soll nachweisen, dass eine optimierte Immunzelltherapie mit anti-humanen CD4-Antikörpern die unerwünschte immunologische Reaktion (GvHD) verhindert, ohne die Anti-Tumor-Wirkung (GvL) der transplantierten Zellen zu beeinträchtigen.
Diese optimierte Immunzelltherapie wird in einer klinischen Prüfung getestet, um das Überleben von Leukämiepatienten zu verbessern.
Nicht nur Patienten mit hämatologischen Erkrankungen würden von einer verbesserten Immunzelltherapie profitieren, sondern auch Patienten mit Autoimmunerkrankungen oder Immundefekten, die durch eine hämatopoetische Zelltransplantation geheilt werden könnten.
Das Produkt
Palintra®
Das mit Antikörper behandelte Transplantat wird als Arzneimittel für neuartige Therapien (engl. advanced therapy medicinal product, ATMP) definiert.
Das Ausgangsmaterial für das ATMP Palintra® ist ein allogenes
mobilisiertes Zelltransplantat. Dieses wird in einem definierten Prozess unter sterilen Bedingungen mit
dem Anti-CD4-Antikörper MAX.16H5 inkubiert. Der Herstellungsprozess gewährleistet eine nur geringe Menge
freier Antikörpermoleküle im finalen ATMP Palintra®.
Anschließende Qualitätskontrollen, wie die Detektion freier
Antikörpermoleküle sowie Sterilitätstests, dienen der Überprüfung der Sicherheit des
Produktes.
Wir haben immer Interesse am wissenschaftlichen Austausch und Know-how-Zuwachs. Sollten Sie unser Projekt spannend finden, wenden Sie sich gerne an uns. Unser Projektmanagement steht Ihnen zur Verfügung.
Antikörper MAX.16H5®
Das mit Antikörper behandelte Transplantat wird als Arzneimittel für neuartige Therapien (engl. advanced therapy medicinal product, ATMP) definiert.
Das Ausgangsmaterial für das ATMP Palintra® ist ein allogenes
mobilisiertes Zelltransplantat. Dieses wird in einem definierten Prozess unter sterilen Bedingungen mit
dem Anti-CD4-Antikörper MAX.16H5 inkubiert. Der Herstellungsprozess gewährleistet eine nur geringe Menge
freier Antikörpermoleküle im finalen ATMP Palintra®.
Anschließende Qualitätskontrollen, wie die Detektion freier
Antikörpermoleküle sowie Sterilitätstests, dienen der Überprüfung der Sicherheit des
Produktes.
Wir haben immer Interesse am wissenschaftlichen Austausch und Know-how-Zuwachs. Sollten Sie unser Projekt spannend finden, wenden Sie sich gerne an uns. Unser Projektmanagement steht Ihnen zur Verfügung.
Weiterentwicklung - Wachstumsmarkt Biotech
Unser antikörper MAX.16H5 hat große potentiale zur Behandlung/Heilung weiterer Krankheiten

T-Zell Lymphome
Entwicklung eines Antikörper-Zytostatikakonjugat, das aufgrund der starken Bindung von MAX.16H5 an CD4 gezielt Tumorzellen angreift.
aktuelle Arzneimittelkosten ca. 2,2 Mrd. USD weltweit

Allogene CAR T Zellen
Prophylaxe des Zytokinfreisetzungssyndroms bei der CAR-T-Zelltherapie durch die Modulation CD4-positiver CAR-T-Zelle mit MAX.16H5.
Wegen des Risikos einer GvHD (Graft versus Host Disease) sowie einer HvG-Reaktion (Host versus Graft) werden CAR-T-Zellen derzeit ausschließlich aus patienteneigenen T-Zellen hergestellt, was mit erheblichem Zeit- und Kostenaufwand verbunden ist. Durch die Vorbehandlung mit MAX.16H5 können dagegen allogene CAR-T-Zellen als off-the-shelf-Therapie verfügbar werden.
Dieser allogene Ansatz ist auch deutlich vielversprechender als die Unterdrückung des Zytokinfreistzungssyndroms.
aktuelle Arzneimittelkosten ca. 100 Mio. USD weltweit
Organtransplantation + Autoimmunerkrankung
Wesentliche Erhöhung der Erfolgschancen bei Organtransplantationen durch eine intensive Spülung des zu transplantierenden Organs mit einer MAX.16H5-Lösung und eine Sättigung der CD-4-tragenden Empfängerzellen.
Bei Autoimmunkrankheiten wie MS dient die prophylaktische und damit regelmäßigen Verabreichung von MAX.16H5 dem Ziel, entsprechende Verläufe (MS-Schübe) aufgrund seiner immunmodulierenden Eigenschaften zu verhindern.
aktuelle Arzneimittelkosten ca. 55 Mrd. USD weltweit

HIV
HIV-Infektionen im Falle eines Behandlungsversagens Der Antikörper bindet hochspezifisch an CD4 und kann effektiv mit dem HIV-Virus um die Bindungsstellen konkurrieren und so das Virus am Eindringen in die Zielzellen hindern.
aktuelle Arzneimittelkosten ca. 34 Mrd. USD weltweit (Prognose 2032: 58 Mrd. USD)
Investor Relations
Die Tcell Tolerance GmbH entwickelt innovative Immuntherapien zur gezielten Behandlung von Autoimmunerkrankungen. Unser Fokus liegt auf der Translation wissenschaftlicher Erkenntnisse in klinisch relevante Anwendungen – mit dem Ziel, Patienten neue therapeutische Optionen zu eröffnen und nachhaltige Werte für Investoren zu schaffen.
Ein Investment in Tcell Tolerance bietet Zugang zu einem hochspezialisierten Markt mit erheblichem medizinischem und wirtschaftlichem Potenzial. Unsere strategische Partnerschaft mit der Fraunhofer-Gesellschaft, die Entwicklung des Wirkstoffs Palintra® sowie ein starker Patentschutz bilden die Grundlage für langfristige Wertschöpfung.
Informationen für Investoren
Auf Anfrage stellen wir Ihnen gern weiterführende Unterlagen zur Verfügung, darunter:
- Geschäftsplan und Prognosen
- Vertriebs- und Entwicklungspotentiale
- Unternehmensbewertung
- Studienunterlagen
- Jahresabschlüsse der Tcell Tolerance GmbH
- Pitch Deck 2025
- Finanzielle Prognose 2028–2032 bei erfolgreicher Marktzulassung
- Lizenzvertrag mit der Fraunhofer-Gesellschaft inkl. Nachträge
- Zeitplan für die Entwicklungsaktivitäten von Palintra®
- Marktexklusivität durch Patentschutz
Nehmen Sie gern Kontakt mit uns auf, wenn Sie weiterführende Informationen wünschen oder ein persönliches Gespräch vereinbaren möchten.
Kontakt
Kontaktieren Sie uns, wir freuen uns von Ihnen zu hören.
Sie haben Fragen, Anregungen oder suchen weiterführende Informationen? Dann schreiben Sie uns doch einfach ein E-Mail oder verwenden Sie den Link unten. Wir werden uns umgehend bei Ihnen melden.
Sollten Sie uns persönlich besuchen wollen oder haben einen Termin, dann erreichen Sie uns problemlos mit den öffentlichen Verkehrsmitteln. Direkt vor dem Gebäude befindet sich eine Straßenbahnhaltestelle, die von mehreren Linien angefahren wird. 5 Gehminuten entfernt befindet sich eine S-Bahnhaltepunkt.
-
Adresse:
Karl-Tauchnitz-Str. 8, 04107 Leipzig, Sachsen, Germany -
Telefon:
+49 341 331572-45
-
Fax:
+49 341 331572-48
-
E-Mail:
info@tcell-tolerance.de
© Copyright 2024. All Rights Reserved.